背景
【1739】【2018 ASCO】速围观!最前沿免疫疗法的年度大戏即将上演
来源:肿瘤资讯
如果说肿瘤领域近年来最火的明星,免疫疗法说“我第二,谁敢称第一”。本次ASCO单独设立的治疗进展之免疫疗法专场,关注免疫治疗的最新、最前沿进展,其中既攘括有所耳闻的CAR-T和ACT疗法,也有陌生的Hu5F9-G4、M7824等,说不定某种疗法一不小心就会变为下一个风口,成为未来的王牌。会议上将迎来免疫治疗领域9项重磅前沿研究的口头发言,小编先给您来个剧透。
ICONIC研究: JTX-2011 +/-纳武利尤单抗(Nivo)治疗晚期患者初现疗效(ABS:3000)
ICOS是在活化的T细胞表面表达的共刺激分子,JTX-2011是一种ICOS激动剂,用于刺激CD4 T效应细胞(T eff)并消耗肿瘤内调节性T细胞(Treg)。在ICOS +肿瘤小鼠中采用JTX-2011单药疗法和与抗PD-1的组合疗法均观察到临床前疗效。
方法
基于安全性,目标结合蛋白(TE),免疫分型和细胞因子,复发/难治性肿瘤患者在1期试验(P1)中接受逐渐增加剂量的JTX-2011单药或联合纳武利尤单抗(nivolumab),以及2期试验中的推荐剂量(RP2D)。2期临床试验胃癌(GC)和三阴乳腺癌(TNBC)组合疗法队列已完成入组。ICOS检测通过IHC储存样本(arch)和新鲜治疗前肿瘤活检(bx)或外周血流进行。
结果
164名患者接受≥1次JTX-2011治疗;1期试验纳入71例患者(40例单药疗法,31例组合疗法);2期试验纳入 93例患者(25例单药疗法,68例组合疗法),包括7个GC单药疗法,24例GC和16例TNBC组合疗法。 治疗前接受过≥3线治疗比例:57%GC单药疗法,48%GC组合疗法,56%TNBC组合疗法合。 2期试验JTX-2011推荐剂量为0.3mg / kg q3w单药疗法,240mg q3w与纳武利尤单抗组合疗法。 剂量限制性毒性DLTs:1mg / kg单药治疗时会升高AST / ALT和出现胸腔积液。在0.3mg / kg剂量时:TE> 70%维持超过3周; 外周T eff或Tregs没有显著变化; 1-6小时后IFN-γ剂量依赖性增加。 2期试验不良事件(AEs):单药时药物相关G3-4 8%,组合疗法为13%; 单药时免疫相关AE 4%,组合疗法为21%; 单药时输注相关AE12%,组合疗法为19%。 在配对储存样本和新鲜bx的13例GC组合疗法患者中,6例是ICOS高表达,5例从低表达变为高表达。7例TNBC组合疗法患者配对bx,5/7储存样本为ICOS高表达,4/7新鲜为ICOS高表达。 RECIST抗肿瘤活性:JTX-2011单药疗法:GC中1/7部分应答(PR); 1期试验TNBC中2/5疾病稳定(SD)。 JTX-2011组合:在19例1/2期试验 GC中2例PR(0.1,0.3mg / kg),2例仍在进行的SD; 2期试验15例TNBC中1例PR。在17例可评估的患者中,4例在JTX-2011治疗期间出现了外周CD4 T细胞ICOS 高表达亚群,包括1例PR单药疗法,2例PR组合疗法和1例SD; 尚无出现疾病进展的患者。
结论
在接受过多线治疗的GC和TNBC患者中,JTX-2011 单药疗法和联合纳武利尤单抗组合疗法的耐受性良好,具有抗肿瘤效应。 外周血CD4 ICOS高表达T细胞亚群的出现可能是应答的替代生物标志物。计划进一步开展JTX-2011的临床试验。
ClinicalTrials.gov注册号: NCT02904226
Varlilumab(Varli)联用纳武利尤单抗治疗结直肠癌和卵巢癌耐受性良好(ABS:3001)
背景
临床前研究已证明PD-1阻断剂和Varlilumab(CD27激动剂抗体)存在协同抗肿瘤活性。1期试验结果在评估Varli和纳武利尤单抗(nivolumab)联用安全性的1/2期试验中已报道; 这里报告结直肠癌(CRC)和卵巢癌(OVA)的1/2期试验结果。
方法
每2周接受纳武利尤单抗(1期试验:3 mg / kg; 2期试验:240 mg)的晚期难治性(抗PD-1 / L1初治)实体瘤患者(Q2W)。1期试验队列也接受0.1,1或10 mg / kg Q2W的Varli。 2期试验队列接受Varli 剂量为3mg / kg Q2W(CRC和OVA),0.3mg / kg Q4W(OVA)或3mg / kg Q12W(OVA)。 主要研究终点为安全性(1期试验)和总应答率ORR(2期试验)。
结果
42例CRC和66例OVA患者接受纳武利尤单抗和Varli。 安全性与单药分别使用时一致; 治疗相关的严重不良事件CRC发生3例(混合运动感觉神经病变,肺炎,ALT升高),OVA发生2例(急性肾损伤,肝炎,小肠梗阻)。 在49例(1期试验8例, 2期试验41例)可评估的OVA患者中,5例达到RECIST1.1部分应答(PR)(10%;所有2期试验),19例达到疾病稳定(SD)(39%; 1期试验6例, 2期试验13例)。治疗过程中活检显示PD-L1表达(p <0.006)和CD8 + T细胞增加(p <0.005),在预后更好的(PR或≥16周的SD)患者中比例更高,p <0.017和p <0.002。 在41例可评估的CRC患者中(1期试验21例, 2期试验20例),2例(5%; 1期试验1例, 2期试验1例)达到PR(1期试验患者 MSI-低表达,2期试验患者 MSI-高表达; 2例均为PD-L1阴性),7例达到SD(17% ; 1期试验3例, 2期试验4例)。 89%的CRC患者在基线时肿瘤PD-L1表达阴性。与OVA相比,在CRC 患者治疗期间肿瘤PD-L1表达或CD8 + T细胞增加不常见,与整体临床效应较小相关。
结论
Varli与纳武利尤单抗联用耐受性良好,没有毒性相加的证据。 在OVA患者中,治疗引起显著的肿瘤变化,这与更好的预后相关。对OVA患者的进一步分析将探索多变量给药方案对临床结果和生物标志物的影响,通过进一步的肿瘤分子谱分析研究调节某些患者T细胞和PD-L1缺乏增加的机制。
ClinicalTrials.gov注册号:NCT02335918
Hu5F9-G4在晚期实体瘤患者中的首次I期研究显示抗肿瘤活性(ABS:3002)
背景
Hu5F9-G4(5F9)是一种可抑制CD47的人源化单克隆抗体,CD47为癌细胞上过度表达的免疫调节分子,是癌细胞为了避免被巨噬细胞吞噬而发出的“别吃我”的信号,5F9可增强肿瘤细胞吞噬作用和T细胞启动,临床前研究显示5F9对多种肿瘤具有活性。
方法
采用3 + 3设计将患者纳入3个剂量递增组中(ClinicalTrials.gov注册号:NCT02216409)。 A组(11例)将1mg / kg的5F9设定为随后在B组和C组中使用的第1最优周(wk)起始剂量。B组(14例)评估了从第2周开始每周较高的维持剂量,C组(18例)在第2周评估以外的加载剂量。本次报告安全性,PK,PD和疗效数据。
结果
58例患者(中位年龄60岁;先前接受治疗线数中位数为5线)常见肿瘤类型为结直肠癌(CRC),卵巢癌,腺样囊性癌,乳腺癌,胰腺癌和鳞状细胞头颈部肿瘤。 使用启动+加载/维持剂量, 在B组14例患者接受≥20mg/kg 5F9剂量中没有达到最大耐受剂量(MTD),在C组中,20mg/ kg(7例),30mg/ kg(8例)和45mg/ kg(3例)耐受性良好。 C组中与药物有关常见不良事件有疲劳50%,寒战50%,发热45%,贫血39%,头痛34%,淋巴细胞减少28%,血细胞凝集17%,瞬时高胆红素血症17%,肌痛11%。 大多数不良事件为1级或2级,发生在第1 周期(28天),其中3级不常见并且没有累积效应。 由于老年红细胞CD47阻滞引起的暂时性1/2 级急性贫血较为常见,但可通过采用剂量策略缓解。非线性PK 饱和度发生在≥10mg/kg时,导致t½大约延长14 天,5F9水平超过临床前抗肿瘤活性阈值(200 ug / mL)导致> 99%的WBC CD47受体占位。2期试验推荐剂量为第1周1mg / kg初始剂量,然后是30mg / kg每周 x 3,然后是30mg / kg Q2W。 两例患者(卵巢和输卵管癌)达到部分缓解,分别治疗23周和41+周。13 例接受≥20mg / kg 剂量治疗的CRC 患者中,6 例达到疾病稳定SD,中位疗程为18 周。
结论
5F9启动+维持剂量耐受性良好,单药疗法显示出抗肿瘤活性。
ClinicalTrials.gov注册号:NCT02216409
ZUMA-1研究:CAR T细胞治疗Axi-cel对难治性大B 细胞淋巴瘤显示持久应答(ABS:3003)
背景
抗-CD19 CAR T细胞治疗Axi-cel 在ZUMA-1研究中显示出对于难治性大B 细胞淋巴瘤患者显著的临床获益和可控的安全性(Neelapu & Locke et al. NEJM. 2017)。 这些结果获得美国FDA 批准应用于接受≥2线治疗后复发或难治性大B细胞淋巴瘤的成人患者。 在这里我们分析了2期试验ZUMA-1中随时间变化的应答情况。
方法
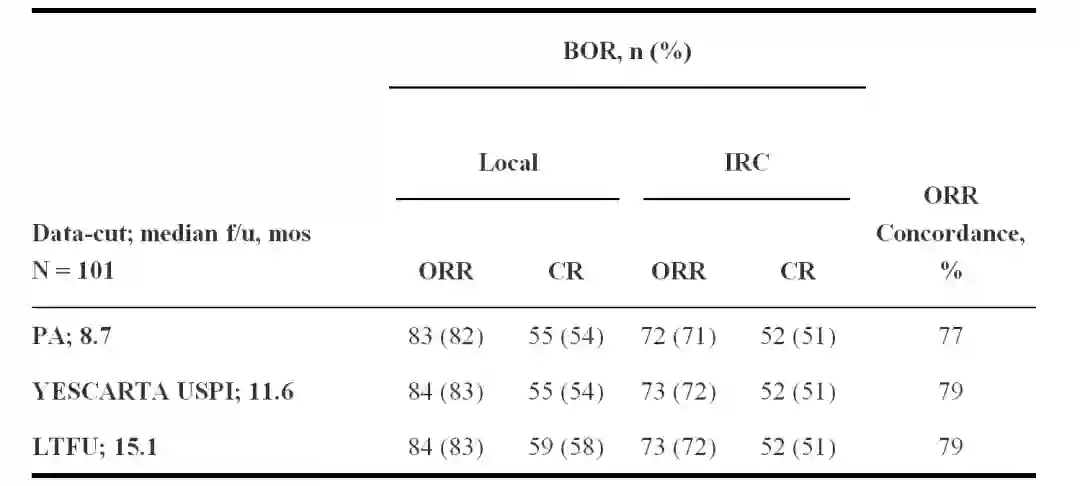
难治性大B 细胞淋巴瘤患者在低剂量环磷酰胺和氟达拉滨治疗后接受2×106细胞/每公斤体重CAR T细胞治疗(Neelapu & Locke et al. NEJM. 2017)。 最佳客观缓解率(BOR)由当地研究者和独立审查委员会评估(IRC; Cheson et al. J Clin Oncol. 2007); 一致性评价为IRC评估与研究者评估患者一致的百分比。
结果
截止到8/11/17,101 例接受Axi-cel 治疗的患者的中位随访时间为15.1个月。尽管研究者评估的主要分析(PA)BOR为82%(中位随访时间为 8.7 个月)与长期随访(83%)(LTFU,中位随访时间为15.1 个月)结果一致,但完全缓解率(CR)从54%上升到58%(如下表所示)。 在1 个月时达到部分应答(PR)的34 名患者中,有11 名(32%)在长期随访中达到完全缓解CR。 在所有评估时间内观察到研究者评估和IRC评估之间的客观缓解率(ORR [CR + PR])高度一致(77% - 79%)。根据研究者评估的应答状态分层进行无进展生存率(PFS)的landmark分析显示,在3个月期间达到疾病控制(疾病稳定SD或更好)的60 个病例中的大多数达到了更长的疾病控制,且12 个月的PFS 率为73%。 3 个月时42 例达到CR, 9 例达到PR,12 个月的PFS 率分别为79%和78%。
表1 研究者评估和IRC评估的缓解率
结论
用Axi-cel 治疗能够诱导难治性大B 细胞淋巴瘤患者高水平持续缓解。 CR率随着长期随访不断增加,提示随着时间的推移应答会持续加深,并且PR 患者在输注后一年可能达到CR。 3 个月时的ORR 可能预示着PFS延长。 Locke 和Neelapu 博士共同为本研究做出了贡献。
ClinicalTrials.gov注册号: NCT02348216
过继性T细胞疗法(ACT)治疗转移性HPV相关上皮癌曙光初现(ABS:3004)
背景
过继性T细胞疗法(ACT)是一种有前景的癌症治疗方式。 然而其在上皮癌中的研究有限。 人乳头瘤病毒(HPV)相关的癌症是一类难治性上皮恶性肿瘤,需要更好的全身治疗。我们进行了ACT治疗转移性HPV相关癌症的临床试验。
方法
本临床试验为II期试验设计,包含两个疾病队列(宫颈癌和非宫颈癌)。 患者接受单次输注的肿瘤浸润淋巴细胞(TIL)治疗,如果可能的话是从TIL传代培养物中获得HPV-癌蛋白反应性(HPV-TIL)。 HPV-TIL输注前先进行淋巴细胞消除预处理,然后进行全身高剂量阿地白介素治疗。
结果
宫颈癌队列中5/18(28%)患者和非宫颈癌队列中2/11(18%)患者发生了客观肿瘤应答。 在宫颈癌队列中,2例患者患者在治疗后53和67个月达到完全缓解CR。 3例患者在三个月时达到部分缓解PR。 在非宫颈癌队列中,1名肛门癌的患者(四个月持续时间)和1名口咽癌的患者(持续五个月)达到部分缓解PR,后者患者先前已接受过六种全身性抗癌治疗,输注HPV-TIL后,多个胸部转移瘤完全缓解,治疗后五个月发生脑转移并手术切除, 他在治疗51个月后没有疾病迹象。
结论
在某些患者中HPV-TIL可介导转移性HPV相关的宫颈癌,口咽癌和肛门上皮癌的消退。 本研究结果支持ACT治疗的HPV相关癌症及其他上皮恶性肿瘤的研究。
ClinicalTrials.gov注册号:NCT01585428
NY-ESO-1c259 T细胞对晚期脂肪肉瘤的治疗具有可行性(ABS:3005)
背景
转移粘液瘤/圆细胞脂肪肉瘤(MRCLS)预后不良。 80-90%的MRCLS肿瘤中存在NY-ESO-1表达。本研究评估识别MRCLS中与HLA-A * 02(SPEAR T细胞)复合的NY-ESO-1衍生肽的亲和力增强的自体NY-ESO-1c259 T细胞(ClinicalTrials.gov注册号:NCT02992743)。
方法
这项开放标签I / II期单臂先导研究评估疗效,安全性和转化研究终点。 满足入组标准的患者≥18岁; HLA-A*02:01+, *02:05+ or *02:06+; IHC检测在≥30%的肿瘤细胞中NY-ESO-1表达强度为2+/3+级的晚期MRCLS; 可测量的病灶; 接受蒽环类药物治疗; ECOG评分0分或1分; 充足的器官功能。 单采血液成分后,将T细胞分离,扩增,用含有NY-ESO-1c259 TCR的慢病毒载体转导,在淋巴细胞清除后的第1天,Flu 30 mg/m2/d and Cy 600 mg/m2/d的第7天和底5天输注1-8×109转导的T细胞。 在4,8,12和24周评估应答情况,然后每3个月评估疾病进展。
结果
37例患者参与筛选; 19例有必要的HLA。 检测13/14例肿瘤中NY-ESO-1存在所需的水平。 2 例患者接受TCR治疗(截至2018年1月30日)。所治疗的患者肿瘤细胞中NY-ESO-1表达3 +级100%,60%肿瘤细胞中表达2或3+级。 第一例患者接受5.00 × 109转导的T细胞并达到了部分缓解PR(未经确认); 目标病灶在第12周时比基线退缩32%。不良事件AEs包括4级淋巴细胞减少症,嗜中性白血球减少症,白细胞减少症, 3级血小板减少症和2级贫血症;均被认为与淋巴细胞减少和解决有关。 也有报告1级CRS发热,1级 AST升高和2级 ALT升高。 CRS已经解决,被认为与TCR治疗有关。 在输注后12周,在外周血中检测到转导的细胞。 第二例患者接受1.04 × 109转导的T细胞并达到部分缓解PR(未经确认); 目标病灶在第4周比基线退缩了37%。AEs包括4级淋巴细胞减少症,3级贫血症,2级血小板减少症,2级 CRS伴发热和皮疹。确认扫描正在进行中。
结论
研究数据表明用MRCLS中的NY-ESO-1c259 T细胞治疗是可行的,具有抗肿瘤作用的潜力。 我们会报告更新的结果。
PIVOT研究:NKTR-214联合纳武利尤单抗治疗晚期实体瘤获得令人鼓舞的缓解率(ABS:3006)
背景
PIVOT是一项正在进行的,开放标签的1/2期研究,在晚期癌症患者(MEL,RCC, NSCLC,TNBC和UC)中应用NKTR-214(214; CD122偏向激动剂)联合PD-1抑制剂纳武利尤单抗(nivolumab)。 214例单药治疗增加了肿瘤中新增殖性CD8+T细胞,并增加细胞表面PD-1和PD-L1表达,表明与抗PD-1治疗具有潜在的协同作用机制。
方法
在1期试验剂量递增方案中,门诊患者接受NKTR-214(0.003,0.006或0.009 mg / kg)与纳武利尤单抗(240 mg或360 mg)Q2W或Q3W静脉注射; 在2期扩展试验中,同时施用2期推荐剂量RP2D为NKTR-214(0.006mg / kg)与纳武利尤单抗(360mg)Q3W。 每8周一次采用RECIST v1.1评估应答。 评估匹配的肿瘤样品的免疫细胞群体,基因表达和T细胞受体库的基线变化。 评估肿瘤基线和PD-L1治疗蛋白表达(28-8 IHC测定)。
结果
截止至2018年2月7日162例患者的安全性可评估(1期试验,n = 38; 2期试验,n = 124)。 在2期推荐剂量患者中(> 25%)所有级别最常见的TRAEs为流感样症状(63%),疲劳(39%),皮疹(38%)和瘙痒症(30%)。 2期推荐剂量的3级及以上 TRAEs为11%。 无患者停止治疗或死于TRAEs。 初治IV期患者共60例可评估疗效(≥1次扫描)(1期试验,n = 30; 2期试验,n = 30;23例MEL,24例RCC,6例NSCLC,4例UC,3例TNBC)。 22/30例2期患者只有1次扫描。23例MEL(1L)患者的ORR(CR + PR)和DCR(CR + PR + SD)分别为52%和78%,18/23 MEL患者已知PD-L1状态,PD-L1(+)患者 ORR为5/9(56%),PD-L1(-)患者为4/9(44 /%)。 24例 RCC(1L)患者的ORR和DCR分别为54%和79%,20/24 RCC患者已知PD-L1状态,PD-L1(+)患者ORR为4/7(57%),PD-L1(-)患者为7/13(54%)。 6例NSCLC(1-2L)患者的ORR和DCR分别为50%和67%,5/6例已知PD-L1状态,PD-L1(-)患者中ORR为3/5(60%)。 4 例UC(1L)的ORR和DCR分别为75%和100%。 3 例TNBC(1-2L)患者的ORR / DCR为33%。 在60例可评估患者中,32/32应答还在持续(0.3+至12.0+个月),45/60例患者仍在接受治疗。
结论
NKTR-214联合纳武利尤单抗耐受良好,无TRAE中断。 初步疗效显示,IO治疗初始1-2L患者中5种肿瘤类型中观察到应答,具有令人鼓舞的ORR / DCR,将会呈现更新的数据。
ClinicalTrials.gov注册号:NCT02983045
PD-L1和TGF-β的双功能融合蛋白M7824治疗HPV相关癌症显希望(ABS:3007)
背景
靶向PD-1 / L1的治疗在HPV相关癌症(HAC)(包括宫颈癌(cerv),肛门癌或头颈部鳞状细胞癌(HNSCC))中应答率约为15-20%。 这些疾病的另一个潜在靶标是转化生长因子-β(TGF-β),HPV +癌症中的全基因组关联研究显示TGF-β显著过表达。 M7824是靶向PD-L1和TGF-β的双功能融合蛋白,其由针对PD-L1的人IgG1单克隆抗体融合至TGF-β受体II的2个胞外结构域(充当TGF-β“陷阱”)起作用。 这里我们报告HAC患者在M7824 1期试验的完全入组剂量递增部分的数据。
方法
本研究是1期,3 + 3剂量递增研究。患者接受2,3,10,20或30mg / kg Q2W 的M7824治疗,直到发生疾病进展PD或不可接受的毒性反应。主要研究目标是安全性和最大耐受剂量(MTD)。 一个关键的次要目标是根据RECIST v1.1评估的最佳整体应答BOR。
结果
截至2018年2月5日,共有16例HAC患者入组(9例,4例肛门和3例HNSCC)。 HPV在11例中阳性+,在5例中未知(英国)。 3/16例患者中发生3级治疗相关不良事件(TRAE)(结肠炎,膀胱炎,胃轻瘫;所有颈椎病)。 值得注意的是这3例患者疾病也有减少。4级低钾血症伴有胃轻瘫,没有看到其他4-5级TRAEs。 唯一的DLT是结肠炎(20mg / kg),没有达到MTD。 9/16(56%)患者治疗有疾病减少,包括持续CR 1 例(cerv; HPV +),持续PR 4 例(2 例HNSCC,2例肛门;全部HPV +),1例未经证实的PR (cerv; HPV uk),2例(2分泌;两种HPV uk)接近PR(-25%,-27%),1例肿瘤重度减少(-9%)(肛门; HPV uk)。 总的来说,6/16(37.5%)有持续的应答,5/6证实。 已知HPV +患者中,5/11(45.5%)有持续确认的应答。
结论
来自M7824的1期临床试验的数据表明,安全性可控,HAC患者的ORR为37.5%,其中已知HPV +患者的确诊ORR为45.5%。 M7824是一种有希望用于HAC或HPV +癌症患者的药物,并将继续在I期和II期试验中进行评估。
ClinicalTrials.gov注册号:NCT02517398
ALT-803联合纳武利尤单抗治疗mNSCLC显活性(ABS:3008)
背景
PD-1 / PD-L1抑制剂在约80%的非选择性非小细胞肺癌(NSCLC)患者中无法产生应答,且获得性耐药将导致大多数应答者的治疗失败。IL-2 / IL-15Rbg激动剂进行的细胞因子治疗在选择的实体瘤中显示出持久应答,尽管应答率很低。 目前还没有关于IL-2 / IL-15Rbg激动剂细胞因子与抗PD1免疫治疗联合试验的公开报道。
方法
在这项Ib / II临床试验中,NSCLC 患者接受抗-PD1免疫联合ALT-803治疗(IL-15超激动剂)。 入组标准包括可测量的病灶,无自身免疫疾病史以及ECOG评分0或1分。纳武利尤单抗Nivolumab每14天IV施用,ALT-803每周皮下施用连续6个月。 Ib期研究的主要目的是探索安全性,耐受性,并定义ALT-803与纳武利尤单抗联合使用的II期推荐剂量(RP2D)。 二期试验入组正在进行中。
结果
截至2018年2月13日,已有38名受试者参加试验。 已观察到剂量限制性毒性DLT。 常见的不良事件是注射部位反应和流感样症状。 ALT-803的II期推荐剂量RP2D每周皮下20 mcg/kg联合每两周一次静脉注射纳武利尤单抗240 mg。 发生在两例患者中的最常见的3级不良事件是淋巴细胞减少症和疲劳,一例患者发生3级心肌梗塞,未观察到4级或5级毒性。 Ib期试验经验中患者PD1免疫治疗复发或难治性肿瘤,疾病控制率为91%(10/11)患者,27%(3例患者)部分缓解和64%(7例患者)疾病稳定。 10例PD-L1阴性肿瘤的患者中,疾病控制率为70%,部分缓解率为30%。
结论
ALT-803与纳武利尤单抗联用组合可安全地在门诊治疗施用。 ALT-803与纳武利尤单抗的组合具有令人鼓舞的抗肿瘤活性,该组合的2期研究正在进行中。
ClinicalTrials.gov注册号:NCT02523469
温馨提示
9项免疫研究专场
报告时间:当地时间6月2日3:00PM-6:00PM
报告地点:Hall B1
http://abstracts.asco.org/214/AbstView_214_221877.html
http://abstracts.asco.org/214/AbstView_214_214493.html
http://abstracts.asco.org/214/AbstView_214_217427.html
http://abstracts.asco.org/214/AbstView_214_211541.html
http://abstracts.asco.org/214/AbstView_214_219769.html
http://abstracts.asco.org/214/AbstView_214_229091.html
http://abstracts.asco.org/214/AbstView_214_217651.html
http://abstracts.asco.org/214/AbstView_214_218971.html
http://abstracts.asco.org/214/AbstView_214_229297.html