人口统计学及基线特征
【1793】免疫检查点抑制剂治疗BRAF突变肺癌和PD-L1表达、肿瘤突变负荷、微卫星不稳定状态的关系
BRAF突变在NSCLC患者中约占2~4%。BRAF V600E被认为是预后不良的预测因子。这部分患者化疗有效率低,BRAF抑制剂联合MEK抑制剂是目前唯一治疗选择,但鉴于费用及不良反应临床实践面临一定困难。免疫检查点抑制剂为NSCLC患者治疗带来新的治疗思路,但对于BRAF突变的患者尚缺乏研究数据。Journal of Thoracic Oncology发表的一项回顾性队列研究为我们带来一些新的启示。
背景
BRAF是位于RAS下游的丝氨酸/苏氨酸激酶,直接激活MEK1/2,导致ERK1/2磷酸化。BRAF基因的活化突变会导致激酶持续活化触发下游调节癌细胞增殖与存活的通路,因此,它是癌症的驱动基因。肺癌中,其突变率为2%~4%,主要见于腺癌亚型,没有种族及性别优势。
V600E突变约占BRAF突变的一半,这些突变主要发生于15外显子上的激活区,导致其编码的缬氨酸由谷氨酸取代(V600E),引起丝氨酸/苏氨酸激酶的基础活性升高。相反,非V600 E突变(分布于外显子11和15)具有的BRAF激酶活化程度不一,通过RAF-1原癌基因、丝氨酸/苏氨酸激酶(CRAF)的反式激活导致MEK活化。V600 E突变常见于女性、非吸烟人群;非V600 E突变常见于曾经吸烟或正在吸烟的患者。
尽管BRAF突变在非小细胞肺癌(NSCLC)的预后意义尚不明确,但一些研究显示V600 E突变患者对于含铂方案化疗反应率低、无疾病生存及总生存(OS)较短。这些患者从BRAF抑制剂获益的可能性更大。事实上,BRAF V600 E突变NSCLC患者抗BRAF药物治疗客观缓解率(ORR)33%~42%、中位无进展生存(PFS)5.5~7.3个月。BRAF抑制剂与MEK抑制剂联合使用似乎是更有效的策略,ORR 63%至64%,中位PFS为9.7个月。而非V600 E突变患者对BRAF抑制剂无效。关于生物制剂对非V600 E突变患者的疗效还缺乏确凿的证据。某些突变(如 G596V, BRAF Y472C)可能具有对抗BRAF或抗MEK的敏感性。
免疫检查点抑制剂(ICPi)在BRAF突变型NSCLC中的疗效目前还不清楚。目前没有大型临床试验针对这部分亚型患者抗程序化死亡1(PD-1)/抗程序化死亡配体1(PD-L1)药物的数据。尚未开展前瞻性研究探索ICPi在BRAF突变型NSCLC的疗效。
PD-L1表达近来已成为晚期NSCLC中预测抗PD-1/PD-L1药物疗效的重要生物标志物。近期研究表明,高肿瘤突变负荷(TMB)和微卫星不稳定性-高状态(MSI-H)对ICPi同样具有预测价值。因此,深入研究BRAF突变NSCLC患者ICPi 疗效与不同疗效预测分子标志物(例如PD-L1表达、TMB和MSI)的相关性是必要的。
方法
研究对象 7个参与研究的以色列癌症中心内部数据库筛选出经过病理证实的BRAF突变晚期NSCLC患者。根据突变情况分为俩组:BRAF V600 E突变组(A组)和非V600 E BRAF突变组(B组)。
研究方法 收集包括PD-L1表达、BRAF突变类型、基线人口统计学、临床和病理特征。TMB 及 MSI 如果经FoundationOne (Foundation Medicine, Cambridge, Massachusetts)检测也要记录。主要研究终点为ICPi的ORR。PFS、OS也要评估。各研究中心检测PD-L1表达,免疫组化检测采用Dako 22C3 PD-L1 IHC platform (Dako, Carpinteria, California) 或Ventana’s BenchMark XT platform (Ventana Medical Systems, Tucson, Arizona)22C3 PharmDx抗体。PD-L1肿瘤比例评分(TPS)根据肿瘤细胞呈部分或完全膜染色的百分比,分为阴性、中等、高(TPS分别为<1%、1%~49%和≥50% 。TMB结果,定义如下:高TMB对应于≥20个突变每MB(MUTS/MB);中TMB对应于6~19 MUTS/MB;低TMB对应于≤5 MUTS/MB。FoundationOne检测MSI状态。结果分别表述为 “高微卫星不稳定(MSI-H)”, “中微卫星不稳定 (MSI-I)”, 及“微卫星稳定 (MS-S)。研究者依据CT根据RECIST 1.1进行疗效评估。
结果
自2013年6月~2017年12月,在7个以色列癌症中心经组织学证实了39例BRAF突变型晚期NSCLC病例。A、B两组除吸烟状态外(p=0.02)基线人口学及临床特征无显著性差异。两组将ICPi作为1/2线 或3线治疗的比例也近似(p=0.18)。
39例患者中,56%的患者接受ICPi治疗。在报告时未接受ICPi治疗的患者ECOG PS评分更高(p=0.002)。接受ICPi治疗的患者接受后线治疗的比例更高(p=0.02)。未接受ICPi治疗的患者几乎没有机会接受后续治疗(p=0.059)。
采用二代测序检测肿瘤组织, FoundationOneTM的患者18例(46%),Oncomine Comprehensive Assay4例(10%), PGDx 1例 (3%)。液体活检5例,(Guardant360®, 4例 (10%); FoundationAct®, 1例(3%)。11例(28%)经热点检测确诊。29例(74%)检测了PD-L1表达。分别有11例(28%)、12例(12%)患者采用FoundationOneTM检测TMB 、MSI。
29例检测PD-L1表达的患者中,PD-L1高表达患者(TPS≥50%)A组和B组分别为42%和50%。两组间PD-L1表达情况存在统计学差异(p=0.05)。11例检测TMB的患者中,只有A组的2例(25%)为高TMB。两组平均TMB分别为5 muts/Mb (范围, 1-42)及 11 muts/Mb (7-14)。12例检测MSI的结果均为MS-S(A组8例,B组4例)。两组在TMB和MSI状态方面没有显著性差异。与未接受ICPi的患者相比,接受ICPi治疗的患者具有较高的PD-L1表达水平(p=0.056)。两例高TMB患者均接受ICPi,未暴露于ICPi的患者没有高TMB(p=0.34)。
ICPi疗效
22例患者(A组57%,B组55%)接受ICPi治疗(纳武利尤单抗nivolumab,11例;帕博利珠单抗pembrolizumab,10例,阿特珠单抗atezolizumab,1例)。21例患者影像学评估充分。1例患者因治疗后短期内死亡没有进行影像学评估。ICPi治疗ORR 28%。两组肿瘤缩小/生长的平均值分别为+38%(-100±260)、-20%(-100±150)(p=0.30)。A、B两组ORR分别为25% (3/12) 及33% (3/9) (p=1.0)。PD-L1表达水平与反应时长无相关性。PD-L1≥50% 及 0-49%患者中位肿瘤缩小/生长分别为-20%(-100 + 260)和+55%(-30±122)(P=0.16)。对于PD-L1≥50% 及 0-49%患者,ORR分别为36%(4/11)和14%(1/7)(p=0.59)。在免疫治疗期间肿瘤缩小的患者中,4例使用帕博利珠单抗作为一线治疗,2例使用纳武利尤单抗作为二线治疗。
PFS
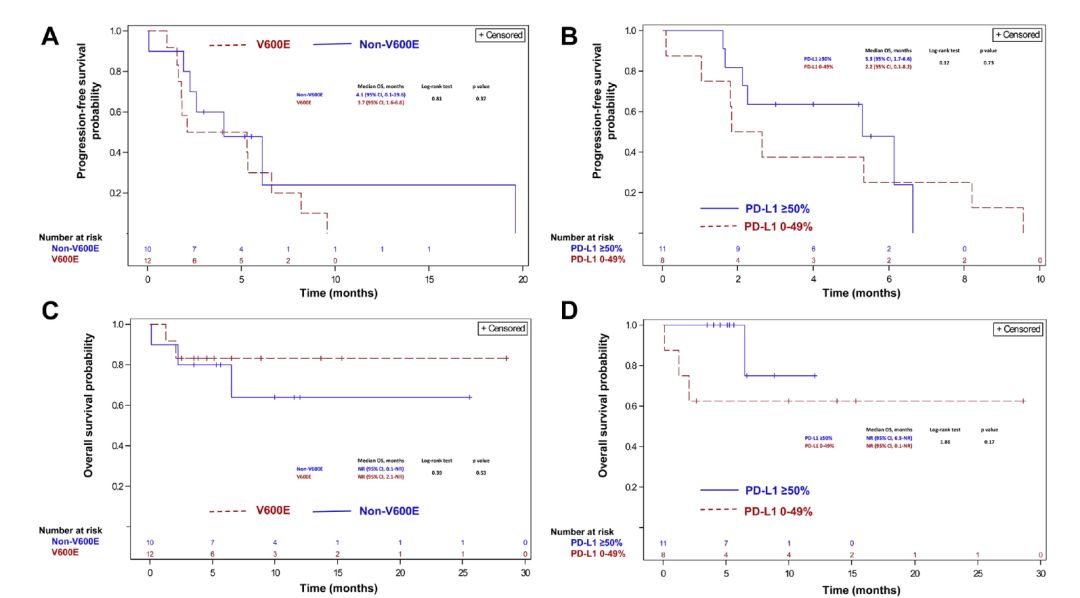
截至分析时,18例(82%)接受ICPi的患者疾病进展(A组92%,B组70%)。两组中位PFS分别为3.7个月(95% CI,1.6~6 6)、4.1个月(95% CI,0.1-19.6)(p=0.37)。对于PD-L1≥50% 及 0-49%接受ICPi的患者,中位PFS分别为5.3个月(1.7~6 6)、2.2个月(0.1-8)( p=0.03)(图1)。
图1 ICPi治疗患者PFS及OS曲线。A BRAF突变患者ICPi治疗PFS曲线 B不同PD-L1表达状态患者ICPi治疗PFS曲线 C BRAF突变患者ICPi治疗OS曲线 D不同PD-L1表达状态患者ICPi治疗OS曲线
自接受ICPi治疗开始,中位随访时间5.5月[IQR 3.5-11.5]时,5例(23%)患者死亡(A组17%,B组30%)。中位OS两组均未达到。
队列中有8例存在BRAF V600E 及PD-L1 ≥ 50%共存。这部分患者平均年龄64岁(54-87);5例为女性;6例无吸烟史;7例为腺癌;仅1例检测了TMB和MSI,结果为低TMB (1 muts/Mb)及MS-S。2/8例患者出现脑转移,5/8例ECOG PS 1分,3/8例ECOG PS 2分。总体而言这部分患者的临床基线特征和病理特征与A组相似。6/8接受ICPi治疗(一线3例;2线2例;三线1例;帕博利珠单抗4例;纳武利尤单抗2例)。2/6患者肿瘤缩小,3/6肿瘤增大包括2例超进展。6例的PFS分别为1.6, 1.7, 2.1, 4+, 5.3, 及 6.6月。4例接受达拉非尼+曲美替尼治疗的患者(一线2例;2线1例;三线1例)肿瘤全部缩小,PFS分别为1.8+, 2.5+, 3+ 及9.2月(图1)。
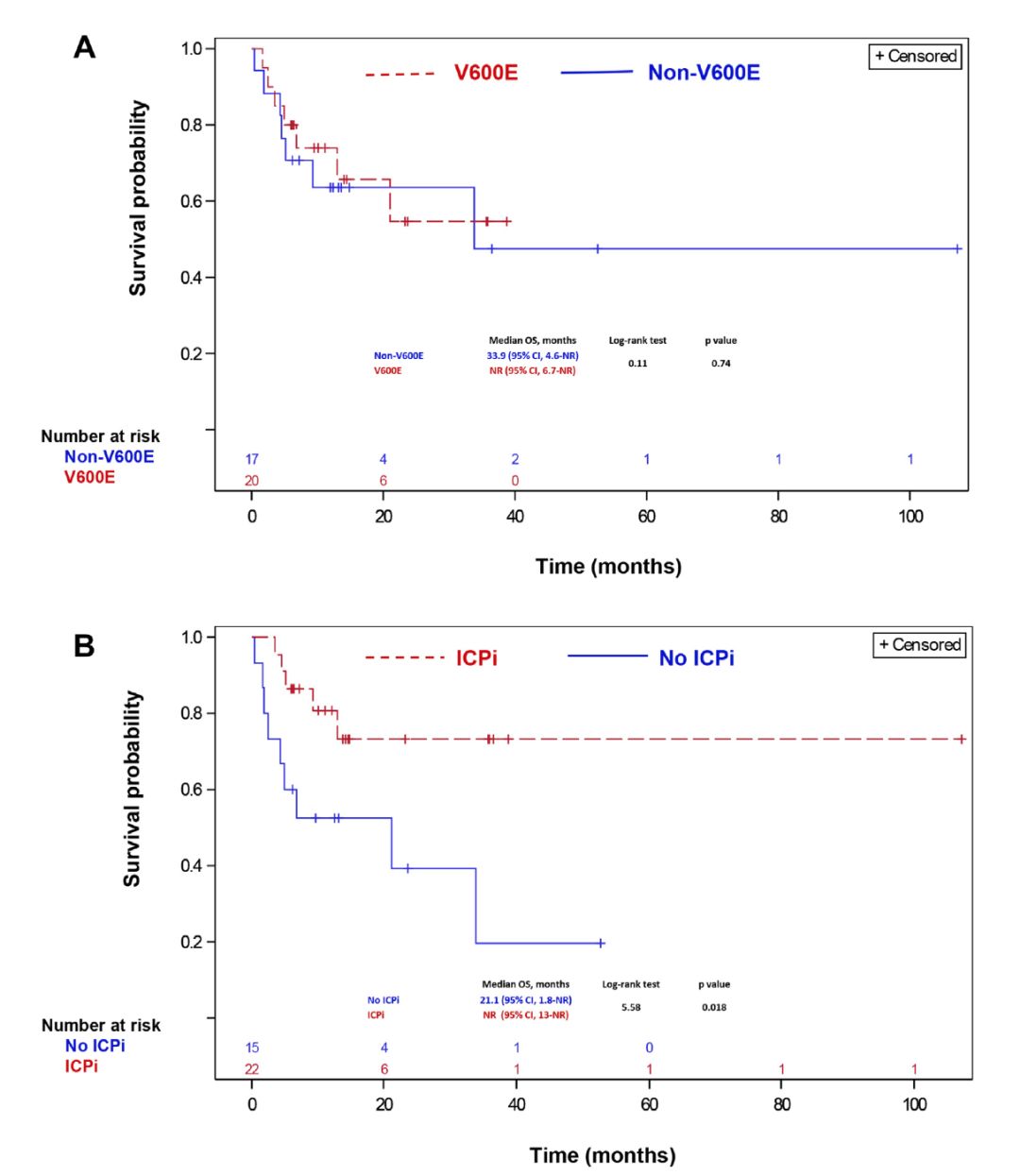
自确诊为晚期疾病算起,中位随访11.2月[IQR 5.9-21.1]时,14例(38%)患者死亡 (A组35%, B组41%)。排除早期患者(两组各1例)后,中位OS,A组未达到(95% CI, 6.7-NR),B组33.9个月(95% CI, 4.6-NR)( p=0.74)。截至分析时,暴露及未暴露于ICPi的患者,分别有5/22 (23%)及 9/15 (60%)死亡。暴露ICPi患者中位OS未达到(95% CI, 13-NR);未暴露于ICPi的患者中位OS 21.1个月(95% CI, 1.8-NR),两组具有统计学差异(p=0.018)。
结论
NSCLC患者BRAF突变与PD-L1高表达,低/中TMB及MSI H有相关性。ICPi对于BRAF V600E及非V600E突变均有疗效(图2)。
图2 自晚期疾病诊断后患者OS曲线。 A不同BRAF突变类型患者OS B 患者OS曲线(ICPi暴露vsICPi未暴露)
点评
这是第一个针对BRAF突变NSCLC患者PD-L1表达及ICPi疗效的队列报道。结果显示,BRAF突变与PD-L1高表达存在相关性。BRAF突变NSCLC患者PD-L1高表达的比例约42%~50%。但对于V600E突变及非V600E突变,PD-L1表达分布存在差别。本研究显示BRAF突变与MSI-H不具有相关性。
值得注意的是,研究中BRAF V600E 及PD-L1 ≥ 50%共存的这部分患者,ICPi 及靶向治疗的结果对于一线治疗规划是非常重要的。结果显示,BRAF抑制剂联合MEK抑制剂的效果更好,而ICPi治疗的6例患者中有2例出现了超进展。鉴于病例数较少,关于靶向治疗与ICPi的优劣还需要进一步的数据确认。
BRAF Mutant Lung Cancer: Programmed Death Ligand 1 Expression, Tumor Mutational Burden, Microsatellite Instability Status, and Response to Immune Check-Point Inhibitors. DOI: https://doi.org/10.1016/j.jtho.2018.04.024
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情
相关内容
社会学/环境学(社会统计学,心理学,人口学,空间统计学,环境统计学等)
工业工程学(质量控制,可靠性分析等)
经济学/金融学(精算学,金融统计学等)
工程学/计算机科学(统计学习,数据挖掘,信号/图像采样/处理等)
基础科学(统计物理学,统计化学等)