【1845】【Lancet Oncol】影像组学分析预估CD8细胞数目,助力精准免疫治疗
影像组学是近年来新兴的研究热点,影像组学分析可以更深层次了解肿瘤的生物学特征,从而辅助临床决策。那么是否可以采用影像组学分析患者的免疫活化状态,从而预测患者接受免疫治疗的疗效呢?近期发布在Lancet Oncology杂志的一项研究评估了影像组学分析在免疫疗效预测上的价值。
背景
影像组学是将医学图像分析转为定量性数据。高维影像数据可以允许我们深入了解治疗表型的特征,不仅可以了解肿瘤的宏观表型,还能深入分析肿瘤组织的细胞和分子特性。影像组学分析的目的在于更深层次了解肿瘤的生物学特征,从而辅助临床决策。影像组学的特征可以补充活检组织分析,同时具有无创的优势,允许评估肿瘤和微环境,肿瘤的空间异质性,并纵向评估疾病进展。
近年来,免疫治疗的应用引领了多个瘤种治疗的变革,包括黑色素瘤、淋巴瘤和肺癌。然而,仅20-50%的晚期肿瘤患者对治疗有响应。因此,亟需探寻可以筛选免疫治疗优势人群的方法。目前,一些研究已经显示,肿瘤和瘤旁的免疫浸润与抗PD-1/L1单抗的疗效相关。据此,可将肿瘤分为3种不同的免疫表型:免疫炎症型、免疫豁免型和免疫沙漠型。免疫浸润性肿瘤表型为弥漫的功能性CD8+T细胞浸润,γ-干扰素信号增加和PD-L1表达以及高肿瘤突变符合。这一类型的肿瘤对免疫治疗敏感。在免疫豁免型肿瘤中,一些生物学特征,如TGF-β,可以组织T细胞浸润肿瘤。在免疫沙漠型肿瘤中,CD8+T细胞较少,表现为高增殖的肿瘤细胞。免疫豁免型和免疫沙漠型都是非炎症型肿瘤。影像组学可以帮助我们评估肿瘤的免疫浸润,可作为免疫治疗的新型预测标志物。本研究旨在开发一个基于影像组学评估肿瘤免疫浸润的方法,并评估这一方法在预测抗PD-1/L1免疫治疗疗效上的价值。
方法
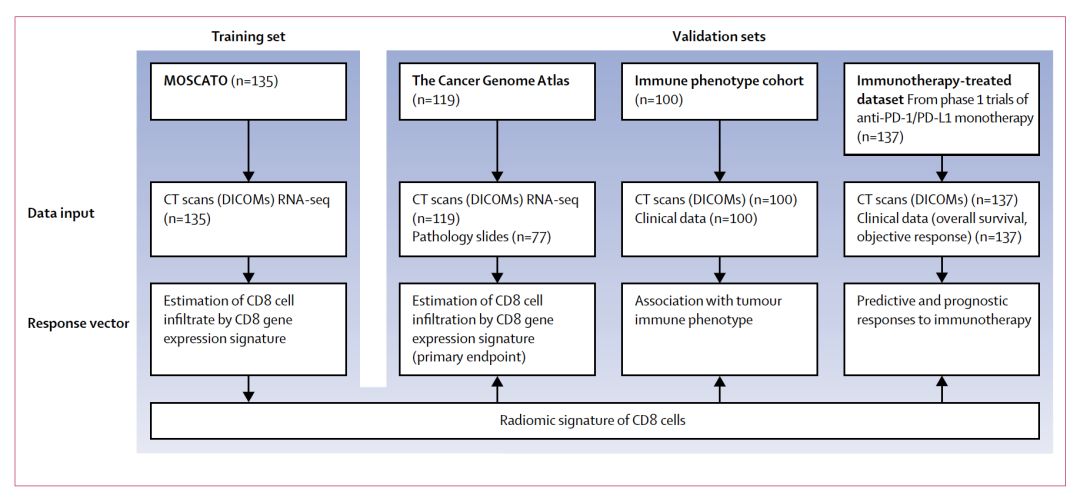
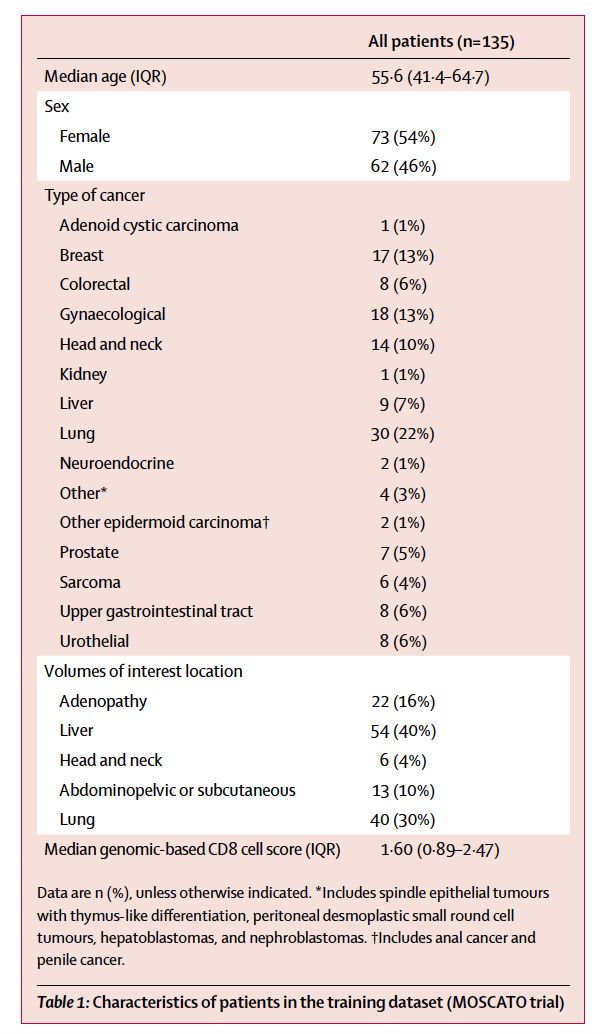
本研究包含多个队列,采用影像组学回顾性分析4个不同队列实体瘤患者的疗效,见图1。以MOSCATO数据集作为训练集,纳入135例MOSCATO研究中的患者,来确定CD8细胞的影像学特征。MOSCATO研究包括多个类型不可根治或转移性实体瘤,见表1,研究旨在探索高通量基因分析能否改善晚期癌症患者的治疗结局。这一数据集中,CT和RNA测序的数据均可获得,允许研究者采用RNA测序数据预估CD8细胞的数目,并进行肿瘤活检标本的影像学特征分析。此外,基于CD8B基因的表达谱分析用于预测CD8细胞丰度。
3个单独的队列用于验证影像学特征。TCGA数据库纳入119例基线有影像学数据和相应转录组数据的患者,该队列包括5种不同类型肿瘤:头颈鳞癌、肺鳞癌、肺腺癌、肝细胞癌和膀胱上皮样癌。这一数据库旨在验证影像组学特征和CD8细胞表达谱的一致性。免疫表型数据库纳入了100例从法国古斯塔夫Roussy研究所中随机选择的患者,入组患者为以下两种极端的肿瘤免疫表型:免疫炎症型和免疫沙漠型。在没有病理评估肿瘤的免疫浸润特征时,将那些对免疫治疗的敏感的肿瘤归类为免疫炎症型,包括淋巴瘤、黑色素瘤、肺癌、膀胱癌、肾癌和微卫星不稳定性高的肿瘤。免疫沙漠型肿瘤定义为那些很少有免疫细胞浸润的瘤种,包括腺样囊性癌、低级别神经内分泌肿瘤和子宫肌瘤。这一数据库旨在评估影像组学特征和肿瘤免疫表型肿瘤的一致性。
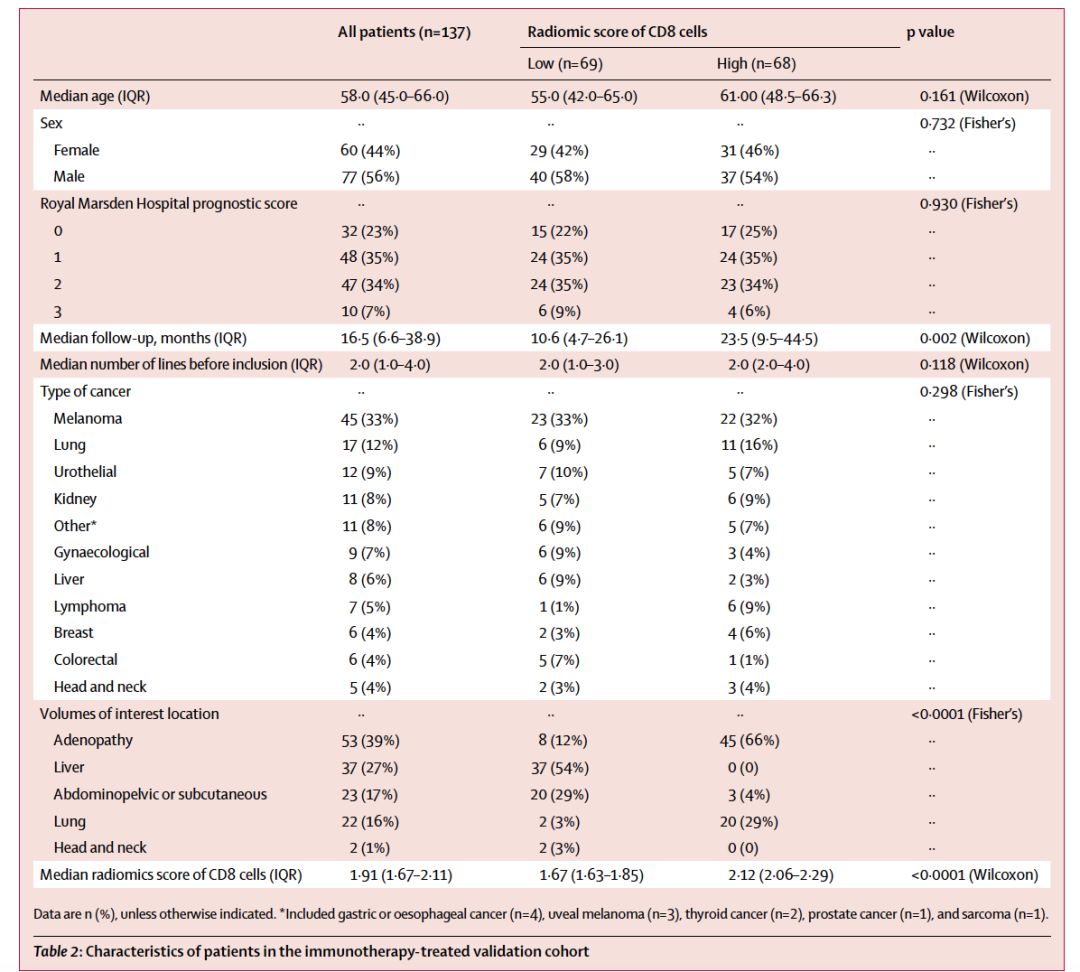
免疫治疗队列包括137例晚期实体瘤患者,这些患者入组了法国古斯塔夫Roussy研究所中进行的抗PD-1/PD-L1单抗的一期治疗研究。这一队列旨在评估影像学特征和接受免疫治疗疗效的关系。
图1. 研究设计
结果
MOSCATO训练集纳入了2012年5月1日至2016年3月31日招募的135例患者,旨在构建影像组学特征分析模型,基线特征见表1。TCGA验证数据集纳入在2017年6月30日前有RNA测序数据和CT图像的435例患者中的119例患者。免疫表型数据库纳入了2005年8月24日至2015年11月19日在法国古斯塔夫Roussy研究所数据库中随机选择的100例患者,其中70例属于免疫炎症型,30例属于免疫沙漠型。免疫治疗队列入组了2011年12月1日至2014年1月31日接受抗PD-1/L1单抗治疗的137例患者,见表2.
表1. 训练集患者的基线特征
表2. 接受免疫治疗的验证队列患者特征
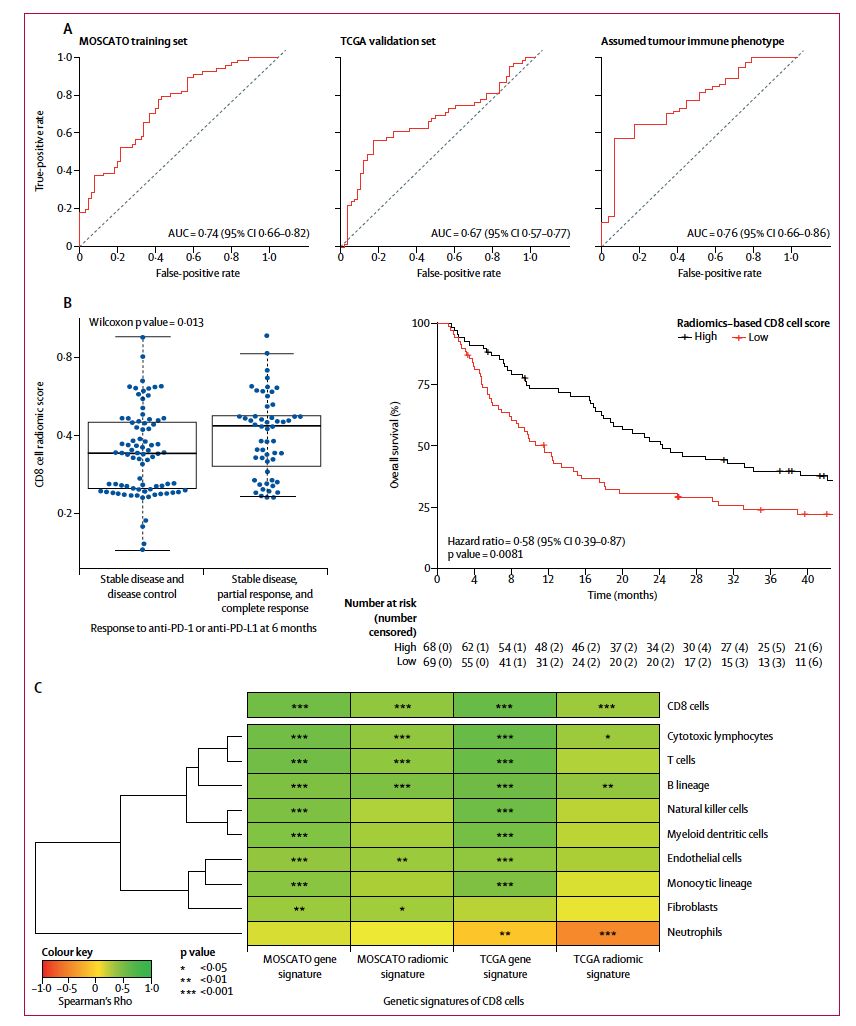
在MOSCATO数据集中,CD8细胞的中位基因组评分 (相当于基因特征表达)为1.6,这一评分采用弹性模型和8个变量,包括5个影像组学特征,两个VOI位置和峰值千伏变量进行估算。训练集中,基于影像组学特征来划分高 vs 低CD8浸润丰度的AUC值为0.74(95% CI 0.66–0.82; p<0.0001),见图3。CD8细胞的影像组学评分与治疗体积无相关性。在TCGA验证集中,采用影像组学特征来预测CD8细胞基因表达特征的AUC值为0.67 (95% CI 0.57–0.77;p=0.0019),见图3。在肿瘤免疫表型队列中,免疫炎症型肿瘤的影像组学评分显著高于免疫沙漠型,分别为1.55 vs -0.28;P<0.0001,采用免疫组学特征划分肿瘤类型的AUC值为0.76(95%CI:0.66-0.86),见图3。在接受免疫治疗的队列中,见下表2,中位随访时间为16.5个月。3个月时,取得客观缓解的31例患者相比于疾病稳定或进展的106例患者,基线的影像组学评分显著更高,P=0.049;但取得疾病控制(CR,PR和SD,n=63)的患者对比疾病进展的患者(n=74),影像组学评分无显著差异,P=0.05。6个月时,取得客观缓解的患者相比于PD/SD的患者,基线的影像组学评分显著更高,P=0.025;此外,取得疾病控制的患者对比疾病进展的患者,基线的影像组学评分也显著更高,P=0.013,见下图3。影像组学评分高的患者相比于评分低的患者,OS显著更优,中位OS分别为 24.3 vs 11.5个月, HR 0.58, 95% CI 0.39–0.87; p=0.0081,见下图3。多因素分析显示,影像组学评分是最强的预测指标,HR 0.52,95% CI 0.35–0.79; p=0.0022。采用MCP-counter基因特征分析估算MOSCATO和TCGA队列中CD8细胞和其他细胞群的基因和影像组学特征,结果显示大多数细胞群和CD8细胞基因特征存在显著相关性,然而两个队列中相关性最明显的均为影像组学评分与T细胞和B细胞群的基因特征。此外,TCGA验证队列中还观察到CD8细胞丰度和肿瘤相关中性粒细胞存在显著负相关。
图2. 训练集和验证集中影像组学特征的效能
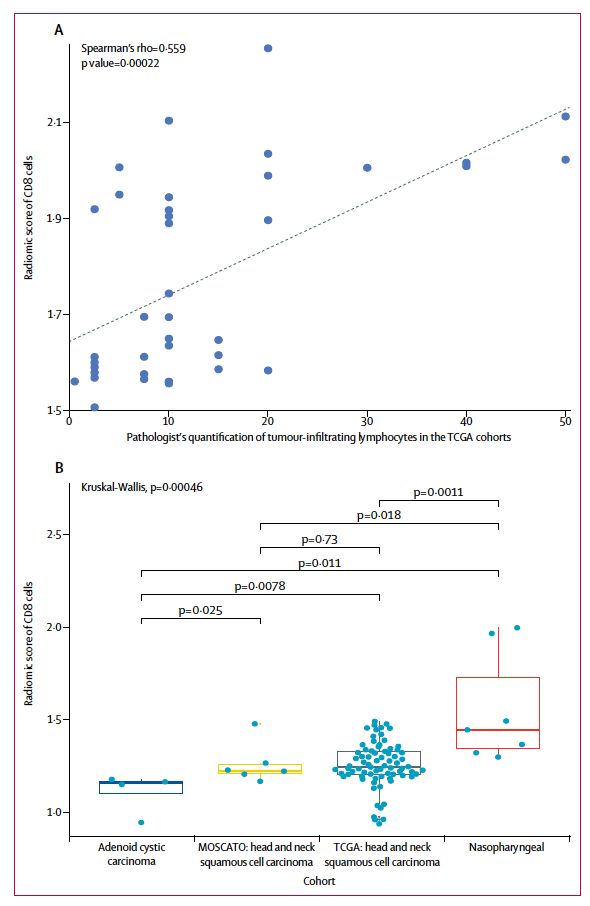
在TCGA验证队列中,分别分析5个不同的瘤种中肿瘤浸润淋巴细胞密度和影像组学评分的相关性,结果显示除头颈部鳞癌外,其余4个瘤种均存在显著相关性,见图4。研究者进一步进行事后分析,将整个研究中纳入的93例头颈鳞癌患者根据组织学类型进行分类。结果显示根据肿瘤免疫浸润的影像组学预测指标可以显著区分不同的肿瘤类型。与文献报道一致,腺样囊性癌相比于头颈鳞癌有更低的免疫浸润,未分化鼻咽癌相比于头颈鳞癌有更高的免疫浸润,见下图4.
图4. 影像组学和病理学评估CD8+T细胞的一致性
结论和讨论
随着免疫治疗的应用越来越广泛,明确患者的免疫状态可以识别那些能从免疫治疗中获益的人群。本研究提示影像组学分析可以是一个高效、无创、可靠的方法评估患者是否能从精准医学中获益。尽管本研究的结果需要在更大样本量的前瞻性研究中进一步验证,但研究提供了一个新的方向,为免疫治疗带来一个新的有潜力但无创标志物。
A radiomics approach to assess tumour-infiltrating CD8 cells and response to anti-PD-1 or anti-PD-L1 immunotherapy: an imaging biomarker, retrospective multicohort study. Published Online August 2018
http://dx.doi.org/10.1016/S1470-2045(18)30413-3
41本肿瘤患者指南丛书
点击下方图片即可免费阅读
28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情