高分辨单颗粒分析在生物样品中的应用
作者:马军,孔令斐,章新政(中国科学院生物物理研究所 生物大分子国家重点实验室)
1 单颗粒分析理论简介
单颗粒分析法研究的理想对象是在三维空间原子尺度上具有全同性的样品。在材料物理中具有全同性的样品并不多见,但是在生物体系中,很多自组装的蛋白质复合物具有较严格的全同性。单颗粒分析法是通过透射电子显微镜对样品进行具有高频信息的二维成像,进而计算得到样品的高分辨三维结构信息。在阐明如何从二维数据获得三维信息之前,首先要说明在单颗粒分析中是如何理解透射电子显微镜中的二维成像。高压电子和生物样品相互作用时,首先忽略了高压电子和样品中电子的非弹性相互作用(可以将非弹性电子在成像中的作用理解为噪音)。而电子和原子核的弹性相互作用可以理解为:电子在途经原子核时,处于未被外层电子完全屏蔽的原子核具有正电势的区域,由于局域的正电势提升了电子速度,导致当电子离开此区域后,虽然恢复到原来的速度(弹性电子),但是其相位发生了相对变化,该正电势和电子相位的变化成正比关系。对于一个样品,电子沿z 轴穿入,样品沿z 轴方向的厚度为t,电子受原子核散射,假设电子一直沿着z 轴附近的区域运动(相位栅近似),那么沿途的原子核对于这个电子的相位改变就是一个简单的求和过程。可以推导对于厚度为t 的样品,在满足相位栅近似的条件下,能解析的分辨率极限与电子波长以及t的乘积的平方根成正比。于是,能量越高的电子(电子的加速电压越高),波长越短,则分辨率极限越高,所以相位栅近似也称为高压近似。而出射波波函数则和相位成指数关系,当相位改变远小于1 时(弱相位近似),出射波波函数的变化和相位的改变也就是沿途正电势的求和(投影)成正比。弱相位近似和相位栅近似对于主要由C,H,O等轻元素构成的、厚度为数十纳米的生物样品完全可以在目前的单颗粒分析分辨率极限(2 Å左右)得以满足。当这两个近似满足时,高能电子和样品相互作用后,经过电镜光路成像,得到样品三维电势受衬度传递函数调制后的二维投影像。然后根据中央截面定理,二维投影像的傅里叶变换(二维)正好是该三维物体的三维傅里叶变换的以电子入射方向为法线的中央截面。因此,如果有不同角度入射的电子束,得到不同角度的中央截面信息,则可以还原所有的三维傅里叶空间的信息,最终得到三维实空间的信息,实现二维到三维的重构。
虽然在近似满足的条件下,冷冻电镜单颗粒分析的理论非常简洁明了,但在实际的数据采集即生物样品的成像过程中,还存在着生物类样品所特有的电子辐照损伤问题。生物样品的电子辐照损伤,不仅仅是电子束直接和样品相互作用造成样品中原子核的位移或价键的破坏,更严重的是大量二次电子对样品的破坏以及失去了价电子之后生物样品中的离子在迁徙中与其他原子和离子的相互作用而导致样品损坏。蛋白质样品的电子辐照损伤是比较复杂的过程,目前的研究认为这类损伤具有积累且不可逆性。因此,样品的损伤与其所受的总电子剂量相关。更多的研究发现,电子对生物样品的损害与样品的温度相关。在液氮温度下,蛋白质样品能耐受3—4 倍的电子剂量而保证其辐照损伤与常温条件处于同一水平。这是单颗粒分析需要使用冷冻电镜的主要原因。即便如此,往往在数个电子每平方埃的剂量下,蛋白质样品的高频信号就已经被破坏。为了保留样品较好的高频信息用于后期的三维重构,冷冻电镜单颗粒分析的数据采集采取了低剂量成像技术(Low-Dose Techniques),做到尽量将有限的所有电子剂量都用于一次成像。尽管如此,低剂量成像的信噪比很低,照片的衬度很差。在液氮温度下,生物样品被包埋在非晶冰中,可以很好地保持生物样品在生理条件下的结构。然而非晶冰的密度与蛋白质的平均密度相差很小,这是导致冷冻电镜衬度差的另一个原因。电子束辐照损伤导致一个蛋白质样品颗粒在得到一个取向的投影后被损坏,因此只能通过对被包埋在非晶冰中随机取向分布的具有结构全同性的其他蛋白质样品颗粒的成像来得到各个取向的投影像。
除了高能电子辐照损伤外,冷冻生物样品在电子束曝光成像过程中的移动是另外一个降低信噪比的重要因素。这种移动部分原因是样品没有达到热稳定(冷冻电镜铜网的热胀冷缩)以及样品台在移动后的不稳定漂移。热稳定性造成的样品移动在将冷冻电镜样品杆进样到电镜内时最为严重,解决方案是进样后等待数十分钟到一个小时不等(与样品杆的型号以及真空状态等相关),等待热稳定后再进行数据采集。此外,通过移动样品台到达收集数据的区域后需要等待数十秒甚至一分钟也是减小样品不稳定漂移量的好办法。另一方面,电子束对样品的辐照本身会产生charging效应(高能电子束和冷冻生物样品相互作用后,使得被照明区域带正电,该正电电场和电子束相互作用造成)。增加铜网碳支持膜的导电性、减小电子束的强度则是减小charging 问题的关键。最新的研究表明,电子束的轰击使得用于包埋、保护生物样品的非晶冰水分子处于一种较为独立、随机的运动状态中,这种水分子的运动使得包埋在非晶冰中的生物大分子在高能电子的辐照下具有类似布朗运动的行为。该效应连同charging等和电子束作用而导致的样品漂移被称为beam induced motion。因此,一个生物大分子在一定的曝光时间中成像是其在这段时间运动过程中的平均投影像。这个平均效应进一步降低了数据的信噪比和衬度。
由于取向随机分布,在三维重构之前,需要知道每一个二维投影的相对取向。而这些参数无法由信噪比很低的二维数据直接得到,目前冷冻电镜单颗粒分析主要采用和三维模型对比的方法来获得这些参数,而这些参数反过来能重构得到优化后的三维模型,优化后的模型又可以再次用于和原始数据对比优化参数,如此迭代,逐步提高模型的分辨率,这是目前通用的重构手段。
在通过迭代的方法获得二维投影的相对取向以及其他与电镜数据采集相关的参数时,实际数据较低的信噪比和衬度都严重影响了这些参数的精确度进而直接限制了三维重构的分辨率。在其他条件都相同、近似满足的情况下,蛋白质复合物尺寸越大,二维投影数据信噪比越高,成像的衬度越好,优化得到的参数越精确,更容易得到高分辨率的三维重构结果。因此,早期冷冻电镜单颗粒分析获得的高分辨率三维重构结果都集中于尺寸较大的病毒(直径60—100 nm)样品。此处的高分辨定义为优于4 Å(当蛋白质复合物的电子密度图分辨率高于4 Å时,便可以根据蛋白质的氨基酸序列信息和氨基酸本身的几何特性将其准确的原子模型完整地搭建出来)。
单颗粒分析法第一次突破4 Å分辨率的重构结果由美国Janelia Research Campus 的Grigorieff实验室于2008 年年初获得。该实验室利用FEI 公司的300 kV F30 冷冻电镜,用底片收集70 nm 左右的轮状病毒(Rotavirus)数据,最终重构得到病毒3.8 Å的三维结构。其中全病毒二十面体对称性重构的整体分辨率达到5.1 Å,利用病毒的十三重非二十面体对称性进行平均后,单个非对称单元的分辨率达到3.8 Å。完整病毒的三维重构结果第一次真正地突破4 Å是于2008 年由美国加州大学洛杉矶分校的周正洪实验室实现。他们利用FEI 公司的300 kV Polara 冷冻电镜,用CCD相机收集数据,最终得到了75 nm 的质型多角体病毒(Cytoplasmic Polyhedrosis Virus,CPV)3.88 Å分辨率的三维结构。此后几年,随着软件和硬件的进一步发展,一系列3.5 Å左右的病毒颗粒三维重构结果相继出现。此时,有数个软件可用于单颗粒分析的高分辨三维重构,例如FREALIGN和IMIRS等。
对于病毒颗粒,单颗粒分析主要是为了确定每个病毒颗粒二维投影成像的衬度传递函数(CTF)参数以及三维模型与二维投影的相对平移与旋转这两类参数。平移和旋转参数可以依靠最小二乘法比较实际成像和三维模型沿不同角度投影得到的二维投影模拟像,寻找和实际成像最接近的二维投影模拟像来获得(projection match);也可以通过最小二乘法比较投影模拟像和实际成像之间由二十面体对称性提供的60 条common line的相似性来得到。在实际计算过程中,为了节省寻找平移和旋转参数的计算时间,首先利用了较大步长下的全局(整个非对称单元的空间角)搜索来初步确定参数范围,然后利用较小步长的局域搜索来提高参数的精确度。此外,在计算过程中还可以引入不同的手段来大幅度地提高计算效率。比如,在对2 个二维图进行比较,需要同时确定2 个平移和1 个in-plane rotation 的旋转参数时,则可利用Patterson 公式首先确定in-plane rotation的旋转参数,然后再去确定对应的2 个平移参数,这在搜索过程中起到了降维的作用,极大地提高了计算效率。另外,也可以利用退火算法等方法避开费时的全局搜索。
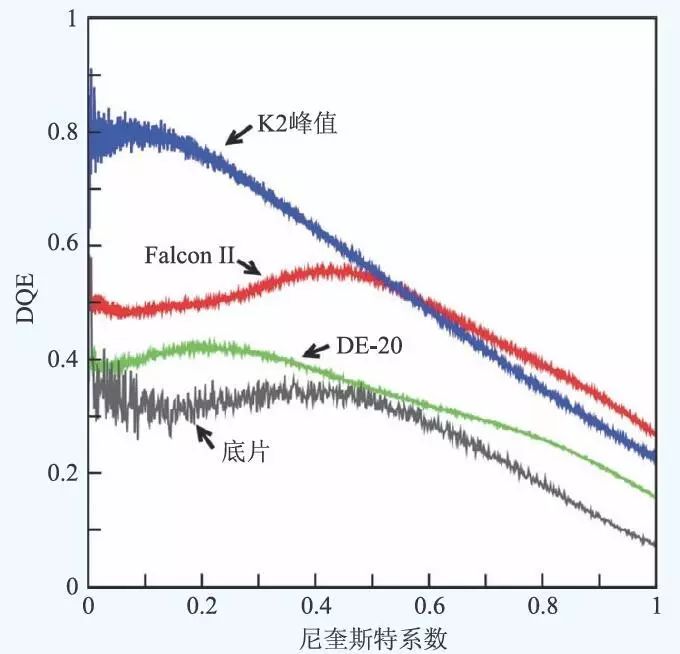
这段时期,硬件的发展如下。新型的冷冻电镜Titan Krios 包含的cryo stage 和热补偿线圈控制磁透镜技术大大减小了热不稳定造成的样品漂移,较大地提高了数据采集效率;三级聚光镜的设计增加了电子的相干性,对提高低剂量下的冷冻电镜数据质量非常有效。由于底片在成像质量(DQE)上优于CCD 相机,所以几个较高分辨率(3.3—3.6 Å)的病毒颗粒三维重构仍然是基于底片的成像技术,但是CCD相机技术为数据自动化采集奠定了基础,大大提高了数据采集效率。
自2013 年来,新颖的成像设备直接电子探测器(Electron Direct Detection Device,DDD)的成熟应用,使得高分辨单颗粒分析应用范围得到了极大扩展。与传统的底片以及CCD探头相比,直接电子探头由于不需要额外的电子信号转光信号,因此在调制传递函数(Modulation Transfer Function,MTF)、量子探测效率(Detection of Quantum Efficiency,DQE)方面都要远优于底片以及CCD相机(Charge-coupled Device,电荷耦合元件)。对于直接电子探测器,探测器的噪音是由于每个高能电子穿过Si 半导体片时激发的信号大小不等,信号的大小呈朗道分布。该朗道分布导致通过在曝光时间内对每个像素上的信号计数进行累加的信号读取方式具有较大的噪音,影响直接电子探头DQE的改善。于是Gatan 公司在设计K2 直接电子探头时,引入了电子计数(electron counting)概念。利用一个阈值来定义探测到的电子,并对探测到的单个电子的信号归一化,很好地解决了信号大小的朗道分布造成的噪音问题。因此在counting 模式下,K2 的DQE在大多数情况下要优于其他非counting 模式下的直接电子探头的DQE(不同相机的DQE比较见图1)。直接电子相机的特点具体表现在以下4 个方面:第一,K2相机在像素的读取速率上进行了优化,能够达到400 帧每秒,从而避免多个电子同时在一个区域产生信号,保证单电子信号的获得。这样,K2 相机在较低的电子剂量率下,能够保证电子计数模式的有效性;第二,高读出速率的优点是在数秒的曝光时间下,直接电子探头收集到的数据不再是单个的照片,而是按时间分布的一系列照片。样品由于温度不稳定、电子束辐照等因素造成的漂移在一定的范围内能反映在这一系列照片中,通过计算分析,不同时刻反应在不同照片上的样品漂移能通过平移得以有效的补偿;第三,由于过高的电子剂量首先破坏的是高频信号,对低频信号的损伤基本可以忽略,于是在系列照片的模式下,当位于后期获得的照片电子剂量过高时,可以通过低通滤波器过滤掉已经被损坏的高频信号,而保留低频信号,使得最后系列照片叠加后产生的数据在低频信号区具有额外的电子剂量,因此可以较大地提高数据在中低频区的信噪比,提高衬度。而中低频区的信号对于精确的平移、转动参数的获得是非常重要的;第四,和底片相比,直接电子探头成像实时地数字化的可视结果可以实时地检测数据质量。而且,冷冻电镜可以长时间的工作(长至数天,连续采集数千张照片),更容易实现自动化的数据采集。
图1 不同相机的DQE。DE20 为绿色,Falcon II 为红色,K2 为蓝色,底片为黑色
直接电子探头DQE的提高缓解了冷冻电镜数据最大的瓶颈低信噪比。冷冻电镜数据信噪比的提高使得小分子量蛋白质复合物数据的信噪比也满足了高分辨单颗粒分析的要求,极大地扩大了单颗粒分析的应用范围。单颗粒分析法在较小蛋白质复合物上的成功应用,解析了多个生命科学领域极其重要的蛋白质机器的高分辨结构。2013年,美国加州大学旧金山分校程亦凡实验室率先利用直接电子探测器解析了约700 kD(~15 nm)的蛋白酶体(Proteasome) 3.3 Å的结构;同年解析了在生命科学领域具有极高意义、约300 kD的膜蛋白辣椒素受体(Transient Receptor Potential Vanilloid type-1,TRPV-1)四聚体的3.4 Å结构。上述研究成果使得冷冻电镜单颗粒分析法在结构生物学领域引起了极高关注,很多以传统的X射线晶体学为主要研究手段的结构生物学家加入冷冻电镜领域,共同以冷冻电镜单颗粒分析法为手段对生物样品开展结构生物学研究,并取得了许多重要的研究成果。根据文献报道,到目前为止单颗粒分析法获得的最高分辨率三维重构结果是美国国立卫生研究院Subramaniam 实验室解析的1.8 Å分辨率的334 kD 的谷氨酸脱氢酶(Glutamate Dehydrogenase,GDH)的结构;获得高分辨率结构解析的最小蛋白质复合物也是Subramaniam实验室93 kD的异柠檬酸脱氢酶(3.8 Å)的结构。
与此同时,傅里叶空间的极大似然法在算法上被广泛应用。首先,理论上信噪比低且噪声大小为高斯分布时极大似然法比直接的最小二乘法更精确,只是需要更多的计算量。其次,傅里叶空间的计算非常便于在不同频率的信号上加入不同权重。权重的大小与不同频率信号之间由于衬度传递函数(Contrast Transfer Function,CTF)的调制等因素造成不一致的信噪比相关。目前较为广泛应用的单颗粒三维重构软件RELION(REgularized LIkelihood OptimizatioN)正是基于上述两点而设计。RELION 软件高度自动化,便于初学者较快地掌握该软件的特点,也是极大似然法被广泛应用的原因之一。
对于常规的生物大分子复合物,冷冻电镜单颗粒分析法获得了较好的结果,但在具体的研究过程中也会遇到许多问题与瓶颈,制约着许多生物大分子结构的解析。主要问题存在于以下几方面。
目前,对于高质量、均一的蛋白质样品而言,冷冻电镜制样成为其最大的瓶颈,而在制样上的主要问题是气液界面。目前广为使用的冷冻电镜制样方式为快速冷冻法。简单来说,就是将液体样品加在透射电镜载网上,用滤纸吸走多余的液体,使得在载网上的碳膜孔中形成数十到数百纳米的薄膜,最后将载网迅速投入液态乙烷快速降温冷冻。在用滤纸吸走多余的液体时,缓冲液薄膜会生成稳定的气液界面,在冷冻前,这个气液界面可能会存在1 s 甚至更长的时间。气液界面的存在导致蛋白质缓冲液不再各向同性。有些蛋白质在这种薄膜中由于气液界面而形成特定的取向分布,导致非晶冰中的样品没有遵循随机取向。另外气液界面外部的疏水性也可能是许多蛋白质复合物在冷冻过程中结构被破坏的原因。这两个问题在蛋白质复合物的冷冻电镜制样过程中是非常常见的现象,直接后果是结构分析实验无法继续。目前人们尝试加入一定量的去污剂或带电小分子、在载网的碳膜孔上加镀超薄碳膜或者在冰比较厚的地方收集数据等手段。然而这些经验性的尝试往往耗费数个月,而且解决问题的可能性也不高。所以,目前气液界面性质的探讨以及发展一种能够解决气液界面问题的新颖的制样方法是冷冻电镜单颗粒分析领域亟待解决的前沿科学问题。
对于尺寸较大的样品,由于有较好的衬度,比较容易获得三维重构必需的各种参数,因此相对比较容易达到较高分辨率(优于4 Å)的重构结果。但是如果想继续提高分辨率,考虑需要的数据量和数据采集效率后,同等分辨率要求下,粗略估计样品的数据采集时间与样品直径的4 次方成正比。因此,尤其是对于没有对称性的大样品,数据采集效率以及计算效率的提高对于高分辨结构解析是非常有利的。目前,数据采集自动化方面的优化以及新的计算解决方案,例如图形处理器(Graphics Processing Unit,GPU)计算可能会对低对称性的大复合物的结构解析有较大的帮助。此外,当样品的大小在100 nm左右甚至以上时,按照目前的理论,相位栅近似和弱相位近似在高频区开始失效,分辨率因此受限于4 Å左右甚至更低。绕开这些近似的理论方法已经有所讨论,但是应用于信噪比很低的实际数据,这些算法效果不佳。随着新的硬件的成熟和数据质量的提高,这些算法或者新的算法是否会有更好的效果有待验证。另外,实际计算有时反而比理论预测更乐观,微晶电子衍射三维重构就是一个典型的例子。在数百纳米甚至上微米的晶体上,按照现有理论,电子的动力学效应完全占主导地位,电子的衍射强度和该晶体非对称单元中蛋白质的结构因子差别很大。但是,实际数据的处理忽略了动力学效应,结果却令人满意。导致这一结果的原因值得进行探索。
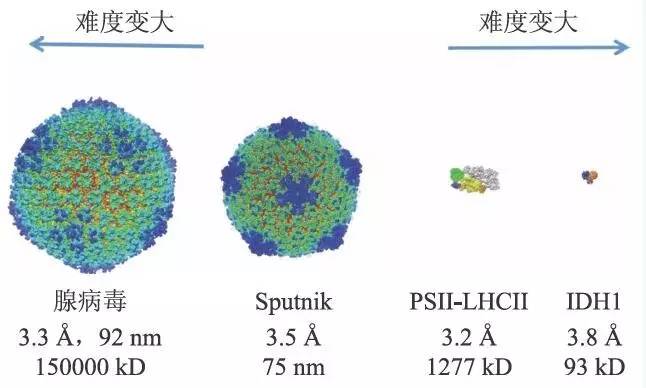
图2 不同类型的蛋白质复合物的冷冻电镜高分辨率结构:腺病毒(EMD-5172),Sputnik 病毒(EMD-5495),PSIILHCII超复合物(EMD-6617),IDH(EMD-8192)。随着样品尺度的过大和过小,蛋白质复合物原子分辨率结构解析的难度增加
对于100 kD左右的蛋白质机器,额外的非晶冰产生的噪音对成像质量影响非常大,冰薄(制样好坏)是结构分析成功与否的关键因素。一方面,目前直接电子探测器的DQE离理论值还有一定的上升空间,可以期待新一代更好的直接电子探测器可以降低较小蛋白质机器的结构分析难度,进一步扩大高分辨单颗粒分析的应用范围(图2)。另一方面,相位板的应用在理论上可以在较大的频率范围内提高信噪比,但是相位板的引入也会额外地产生新的噪音。新型vita 相位板技术在稳定性上仍有提高的空间。目前利用相位板技术解析了约200 kD 的核小体核心颗粒(Nucleosome Core Particle)的3.9 Å结构和约700 kD 的蛋白酶体的3.2 Å结构,相位板技术在单颗粒分析中的应用有待进一步扩展。
本文选自《物理》2017年第2期
1. 量子力学诠释问题(一)
2. 量子力学诠释问题(二)
3. 高温超导研究面临的挑战
10. 费米子家族新成员——突破传统分类的三重简并费米子的实验发现
END
更多精彩文章,请关注微信号:cpsjournals